Методические указания к расчету диаграмм
состояний соединений меди при повышенных температурах
(по курсу
«Кондиционирование теплоносителя», специальность 10.06)
Петрова
Т.И.
Для прогнозирования протекания коррозионных процессов в пароводяном тракте тепловых электростанций необходимо иметь данные о формах существования продуктов коррозии конструкционных материалов.
Для оценки форм существования продуктов коррозии могут быть использованы диаграммы состояний (диаграммы Пурбэ), которые позволяют установить взаимосвязь между окислительно-восстановительным потенциалом среды, значением рН и формами существования продуктов коррозии. Использование этих диаграмм позволяет оценить возможность протекания коррозионных процессов при различных водно-химических режимах.
Одним из конструкционных материалов, используемых в энергетике, являются сплавы на основе меди, например, латунь. При коррозии этих сплавов образуются продукты коррозии меди, формы существования которых состав которых зависят от окислительно-восстановительного потенциала среды, рН и состава примесей. При повышении температуры среды области существования соединений меди в зависимости от окислительно-восстановительного потенциала и рН могут изменяться. Поэтому важно иметь данные о формах существования соединений меди в зависимости от окислительно-восстановительного потенциала и рН в широком диапазоне температур.
При расчете диаграмм состояний для соединений меди в системе вода-медь при повышенных температурах используются следующие основные уравнения:
![]() , где: (1)
, где: (1)
ЕТ – потенциал реакции окисления-восстановления при температуре среды;
![]() – стандартный
потенциал реакции окисления-восстановления при температуре среды;
– стандартный
потенциал реакции окисления-восстановления при температуре среды;
R – универсальная газовая постоянная;
Т – температура;
n – число электронов, принимающих участие в реакции окисления-восстановления;
F – число Фарадея;
аокисл, авосст – активность окисленной и восстановленной форм соответственно.
![]() , где: (2)
, где: (2)
![]() –стандартный
изохорный потенциал окислительно-восстановительной реакции при температуре
среды
–стандартный
изохорный потенциал окислительно-восстановительной реакции при температуре
среды
![]() , где: (3)
, где: (3)
KТ – константа равновесия реакции при температуре среды.
![]() , где: (4)
, где: (4)
![]() – изменение энтальпии;
– изменение энтальпии;
DS – изменение энтропии
Для проведения расчета необходимо выбрать парциальные давления кислорода и водорода в воде и концентрацию растворенной меди.
Далее необходимо определить границы термодинамической устойчивости воды, исходя из следующих реакций:
2Н2О ![]() О2
(г) + 4Н+ + 4
О2
(г) + 4Н+ + 4![]() (5)
(5)
Н2 (г) ![]() 2Н+ +
2
2Н+ +
2![]() (6)
(6)
Для уравнений 5 и 6 рассчитываются значения окислительно-восстановительных потенциалов:
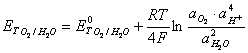 (7)
(7)
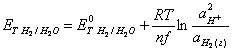 (8)
(8)
После определения границ термодинамической устойчивости воды при заданной температуре рассматриваются основные реакции, которые могут протекать в системе Cu – H2O. При этой температуре: в первую очередь рассматриваются реакции окисления-восстановления и реакции замещения.
Из реакций окисления-восстановления основными являются:
Сu ![]() Cu+ +
Cu+ + ![]() (9)
(9)
Cu + 0,5 H2O
![]() 0,5 Cu2O +
H+ +
0,5 Cu2O +
H+ + ![]() (10)
(10)
Cu+ ![]() Cu2+ +
Cu2+ + ![]() (11)
(11)
Cu+ + H2O = CuO + 2H+ + ![]() (12)
(12)
0,5 Cu2O
+ 0,5 H2O ![]() CuO
+ H+
CuO
+ H+ ![]() (13)
(13)
Cu ![]() Cu2+ + 2
Cu2+ + 2![]() (14)
(14)
Из реакций замещения могут быть рассмотрены следующие:
Cu+ + 0,5
H2O ![]() 0,5 Cu2O +
H+ (15)
0,5 Cu2O +
H+ (15)
Cu+ + H2O = CuO + 2H+ (16)
НСu![]() + OH
+ OH ![]() Cu
Cu![]() + H2O (17)
+ H2O (17)
В качестве примеров приводится расчет значения окислительно-восстановительного потенциала, при котором металлическая медь окисляется до Сu2+ (реакция 14) и значения рНТ, при котором Сu2+ при взаимодействии с водой образует СuO (реакция 16) для температуры 354° С.
В соответствии с уравнением 14 окислительно-восстановительный потенциал может быть рассчитан по следующему уравнению:
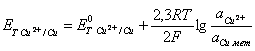 (18)
(18)
Зная величину нормального окислительного потенциала при температуре 25° и
значение ![]() , которое по данным [1] составляет 0,879×10-3 В/°C,
, которое по данным [1] составляет 0,879×10-3 В/°C,
![]() может быть определено
по уравнению:
может быть определено
по уравнению:
![]() (19)
(19)
После
подстановки значений ![]() , R,
T и F уравнение (18)
приобретает вид:
, R,
T и F уравнение (18)
приобретает вид:
![]() (20)
(20)
Для концентрации растворенной меди в воде 10-7 моль/кг ЕТ Cu2+/Cu равно 0,190 В.
В соответствии с уравнением реакции 16 при определенном значении рНТ ионы двухвалентной меди, взаимодействуя с водой, образуют СuO.
Значение рНТ может быть определено из уравнения константы равновесия уравнения 16:
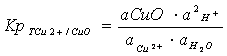 (21)
(21)
После логарифмирования и замены lgaH+T на – рНТ уравнение (21) приобретает вид:
![]() (22)
(22)
Из уравнения 3, описывающего взаимосвязь между КРТ и DFPT cледует, что
![]() (23)
(23)
Совместное решение уравнений 22 и 23 позволяет определить значение рНТ, при котором может осуществляться переход Сu2+ в Сu:
![]() (24)
(24)
Для определения DFPT могут быть использованы справочные данные или произведен расчет по формуле:
DFPT = SDFTобр. в= в – SDFTисх. в = в (25),
где:
SDFTобр. в= в, SDFTисх. в = в – сумма энергий образования исходных соединений и соединений, образовавшихся в процессе реакции.
Для реакции 16 DFPT может быть представлен в виде:
DFPT Cu2+/CuO = (DFT CuO + 2 DFTн+) – (DFT Cu2+ + DFTн2О) (26)
На рис. в качестве примера представлена диаграмма состояний для соединений меди при температуре воды 354° С и давлении 18 МПа.
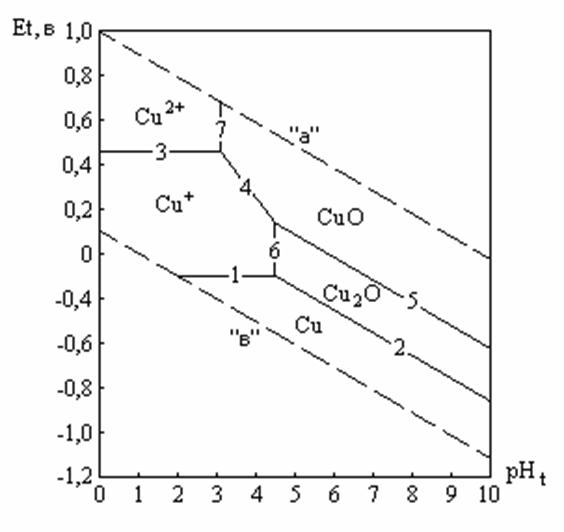
Рис. Диаграмма состояний для соединений меди при

температуре 3540С (P = 18 МПа).
«а» - H2O ® O2
«в» - H2O ® H2
Литература
1. Уикс К.Е., Блох Ф.Е. Термодинамические свойства 65 элементов, их окислов, галогенидов, карбидов и нитридов. Изд-во Металлургия, Москва, 1965 г.